Avance en la lucha contra el cáncer: científicos crean una tecnología de precisión que pueden potenciar la inmunoterapia
Esta nueva tecnología oncológica podría lograr avances significativos para que el cáncer deje de esconderse y sea detectable por el sistema inmune del paciente, sin los efectos secundarios clásicos. Así funciona este nuevo dispositivo.
Así es el dispositivo que podría cambiar el futuro del tratamiento contra el cáncer
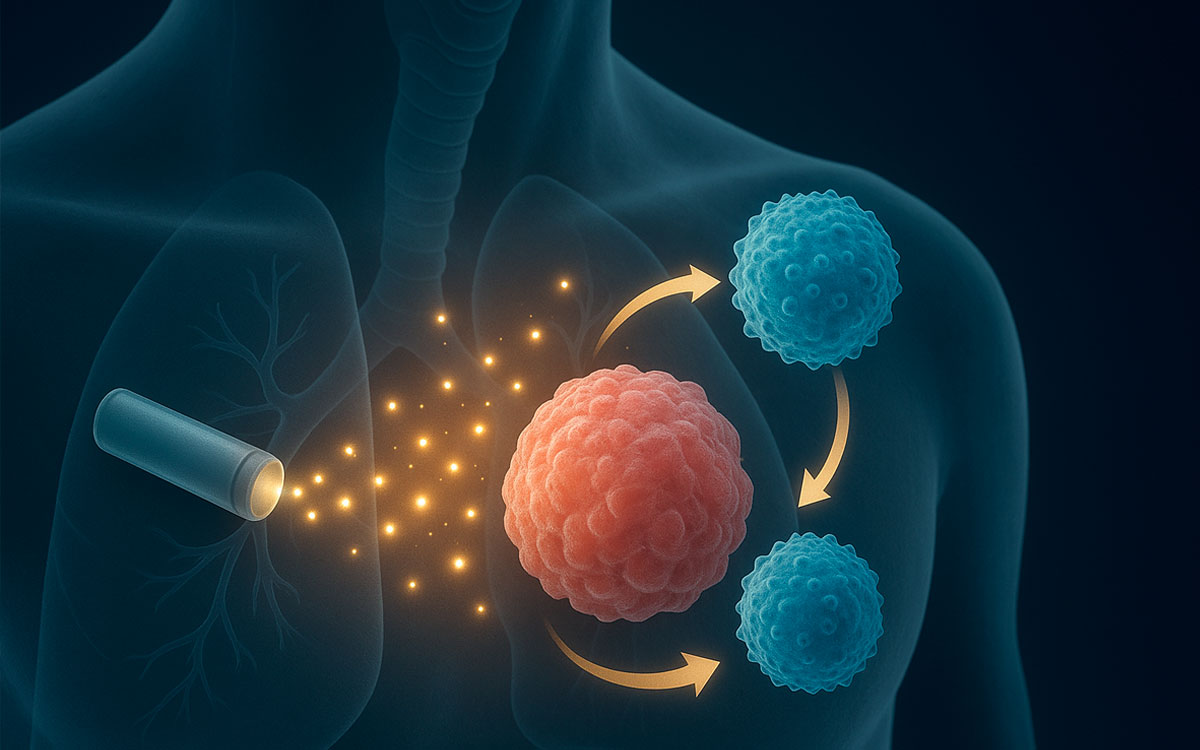
Un revolucionario avance en la lucha contra el cáncer está comenzando a modificar el enfoque terapéutico en distintos tipos de tumores. Científicos de la Universidad Rice, en Estados Unidos, desarrollaron un dispositivo implantable que libera interleucina-12 (IL-12) directamente en el sitio del tumor. Esta tecnología podría transformar la inmunoterapia, al activar una respuesta inmune precisa y duradera sin generar los efectos colaterales tóxicos que acompañan a tratamientos tradicionales como la quimioterapia o la radioterapia.
La propuesta consiste en una especie de “fábrica de citoquinas” implantable que libera de forma localizada la IL-12, una sustancia que alerta al sistema inmunológico y lo lleva a atacar al tumor con mayor eficacia. El equipo detrás del desarrollo, encabezado por el bioingeniero Omid Veiseh, publicó sus hallazgos en The Journal of ImmunoTherapy of Cancer, donde destacan su potencial no solo para destruir tumores primarios, sino también para eliminar metástasis distales, una de las grandes barreras de los tratamientos actuales.
Una alarma que se enciende solo donde hace falta
Lo innovador del dispositivo IL-12 radica en su capacidad para liberar citoquinas de forma controlada y específica, activando el sistema inmune únicamente en el área afectada. Como lo explican los propios investigadores, la IL-12 actúa como una alarma localizada: se activa en el tumor y no afecta al resto del cuerpo.
Esto representa un cambio significativo respecto de otras terapias inmunológicas que, al actuar de forma más generalizada, suelen desencadenar reacciones adversas severas. “Diseñamos la fábrica de citoquinas IL-12 para mejorar la inmunoterapia minimizando la toxicidad, una necesidad crítica en el tratamiento de cánceres particularmente agresivos”, afirmó Veiseh.
Resultados prometedores en pruebas con animales
El estudio de la Universidad Rice se encuentra en fase preclínica, pero ya mostró resultados exitosos en ratones y primates no humanos. Los científicos lograron tratar con éxito modelos de melanoma metastásico, así como también tumores colorrectales y pancreáticos.
En todos los casos, el dispositivo IL-12 fue bien tolerado y mostró eficacia tanto en tumores locales como en metástasis a distancia. Según el comunicado de la universidad, “la fábrica de citocinas IL-12 en combinación con inhibidores de puntos de control inmunológico eliminó tumores en múltiples localizaciones en modelos experimentales”.
Una analogía que lo explica todo
Para ilustrar el mecanismo del IL-12, Veiseh recurrió a una analogía futbolística: mientras otras citoquinas reclutan siempre al mismo grupo de linfocitos (jugadores que se cansan rápido), la IL-12 forma un equipo más variado y duradero, que ataca con eficacia y resistencia a largo plazo.
Este nuevo “entrenador inmunológico” permite no solo una mejor respuesta a corto plazo, sino también una respuesta inmunitaria más robusta y prolongada. Esa capacidad de generar memoria inmunológica es clave para evitar recaídas y aumentar la supervivencia de los pacientes.
Un tratamiento menos tóxico que los actuales
Uno de los grandes problemas de la inmunoterapia tradicional ha sido la toxicidad sistémica, que impide muchas veces continuar con el tratamiento o lo vuelve inviable en pacientes debilitados. El IL-12 busca precisamente resolver esta limitación, al aplicar el tratamiento justo donde hace falta, sin afectar órganos ni tejidos sanos.
"El reto sigue siendo tratar tumores sólidos sin causar efectos colaterales", explicó el profesor Nathan Reticker-Flynn de la Universidad de Stanford. "Nuestro estudio no solo prueba la eficacia de esta tecnología, sino también su perfil de seguridad, lo cual es fundamental antes de iniciar ensayos en humanos".
Melanoma: una de las grandes esperanzas del nuevo dispositivo
El melanoma, uno de los tipos de cáncer de piel más agresivos, ha sido uno de los focos del estudio. Este tumor se caracteriza por su rápida diseminación y la dificultad para tratarlo en estadios avanzados. Con el dispositivo IL-12, los investigadores lograron reducir las metástasis pulmonares en los modelos preclínicos y aumentar la supervivencia de los ratones.
Además, al combinar este enfoque con la terapia de puntos de control, se logró activar una respuesta inmune sistémica, es decir, no solo local sino extendida a otros focos tumorales, lo que representa un avance enorme frente a la diseminación tumoral.
Pancreático y colorrectal: los cánceres más letales también podrían beneficiarse
El cáncer pancreático es uno de los más difíciles de tratar, debido a su diagnóstico tardío y la rápida aparición de metástasis. El dispositivo IL-12 ofrece una alternativa al activar el sistema inmunológico justo en el sitio del tumor, con resultados prometedores en fases experimentales.
En el caso del cáncer colorrectal, el escenario es similar. Su capacidad de generar metástasis y resistencia a las terapias habituales lo convierte en un gran candidato para este tipo de tecnología. En ratones con cáncer colorrectal, el tratamiento logró evitar la diseminación tumoral en 8 de cada 9 casos, una cifra alentadora que motiva avanzar hacia la fase clínica.
Un nuevo horizonte en la medicina personalizada
La idea de un tratamiento que actúe de forma específica, localizada, duradera y segura resume los grandes objetivos de la medicina oncológica moderna. El avance del dispositivo IL-12 encarna esa visión, en la que cada tumor es abordado con precisión quirúrgica, sin arrasar con el resto del cuerpo.
Si bien aún falta recorrer un largo camino hasta su aprobación y uso clínico masivo, los resultados preclínicos abren un camino sólido hacia una nueva era en la inmunoterapia contra el cáncer.